

发布时间:2026-02-17
2月17日,中国科学院广州生物医药与健康研究院、华南理工大学、广州国家实验室和西湖大学联合团队在 Cell 发表题为 A single-cell time-series atlas of endothelial cell embryonic development 的研究论文。通过构建小鼠内皮细胞胚胎发育全程的谱系图(http://sted-ec.ccla.ac.cn/),发现血管内皮细胞在小鼠胚胎发育的孕中期,开始分化并逐步建立适配各个器官的内皮细胞。肺血管内皮富集基因Casz1影响肺血管生长、器官特异性分化和肺部的内皮-上皮的细胞互作。
血管贯穿脊椎动物身体的每一个角落,不仅是血液运输的通道,还在器官再生修复中发挥重要功能。血管内皮细胞直接与血液接触,是组成血管的最基本结构单元。既往研究已深入揭示了动静脉血管内皮分化的机制,但各个器官内血管内皮细胞分化并拥有器官特异性的过程和生理意义,目前仍知之甚少。
研究人员发现,小鼠胚胎发育E7(Embryonic day 7)是能够清晰定义内皮细胞的最早时间。早期内皮细胞在E8已开始器官特异性分化,形成心脏心内膜内皮细胞,并在此后的孕中期(E9.0-E13.5)开启中枢神经、肝脏、肺、消化道等多组织的器官特异性分化。在此之后,各个器官中内皮细胞的差异逐渐增大,开始表达各自器官独有的基因调控网络和信号通路。这些内皮器官特异性基因和通路,与对应器官的生理功能紧密相关。
研究人员进一步聚焦人类和小鼠肺血管内皮器官特异性建立的跨物种对比。发现人类和小鼠肺内皮拥有相似的内皮亚群和关键分化时间点(Canalicular stage),但人鼠肺内皮间还存在大量物种特异性基因。这暗示人类与小鼠肺内皮的基因表达动态并不完全相同,因此利用人类细胞谱系大科学研究设施解析人类细胞发育和病变的规律极为重要。
更深入分析发现,Casz1是人类和小鼠肺内皮细胞都高度富集的基因。在内皮细胞中敲除Casz1会阻碍肺血管的生长,阻断肺血管内皮细胞的器官特异性分化。这是由于,Casz1直接结合在肺内皮染色质的启动子区域,这种结合会影响VEGFR2、Foxf1、Car4等肺血管生长和分化关键调控基因的表达。
内皮中Casz1的缺失还会导致肺泡中NKX2.1+和SFTPC+细胞减少,肺泡细胞增殖迟缓,以及肺部内皮-肺泡细胞间互作的减弱。其中,Casz1会调控肺内皮释放旁分泌因子FGF1,影响肺泡细胞的正常增殖发育。
综上,这项工作建立了涵盖26个发育时间点的内皮细胞发育谱系图,解析了内皮细胞器官特异性谱系构建的时空轨迹和分子特征。以肺内皮为例,阐明了器官特异性血管分化的调控机理及其对相应组织的影响。为今后更深入解析血管的器官特异性特征在心脑血管等疾病中的潜在作用,奠定了坚实的基础。
广州健康院陈奇研究员、陈捷凯研究员、彭广敦研究员、华南理工大学刘阳教授、广州实验室曹尚涛研究员和西湖大学裴端卿教授是这项工作的共同通讯作者。广州健康院副研究员林立惠,博士后钟晶,博士生江伏青和博士后王钰翔是本论文的共同第一作者。广州健康院是这项工作的第一完成单位。这项工作得到国家重点研发计划、中国科学院、国家自然科学基金、广东省科技厅、广州健康院等项目的支持。
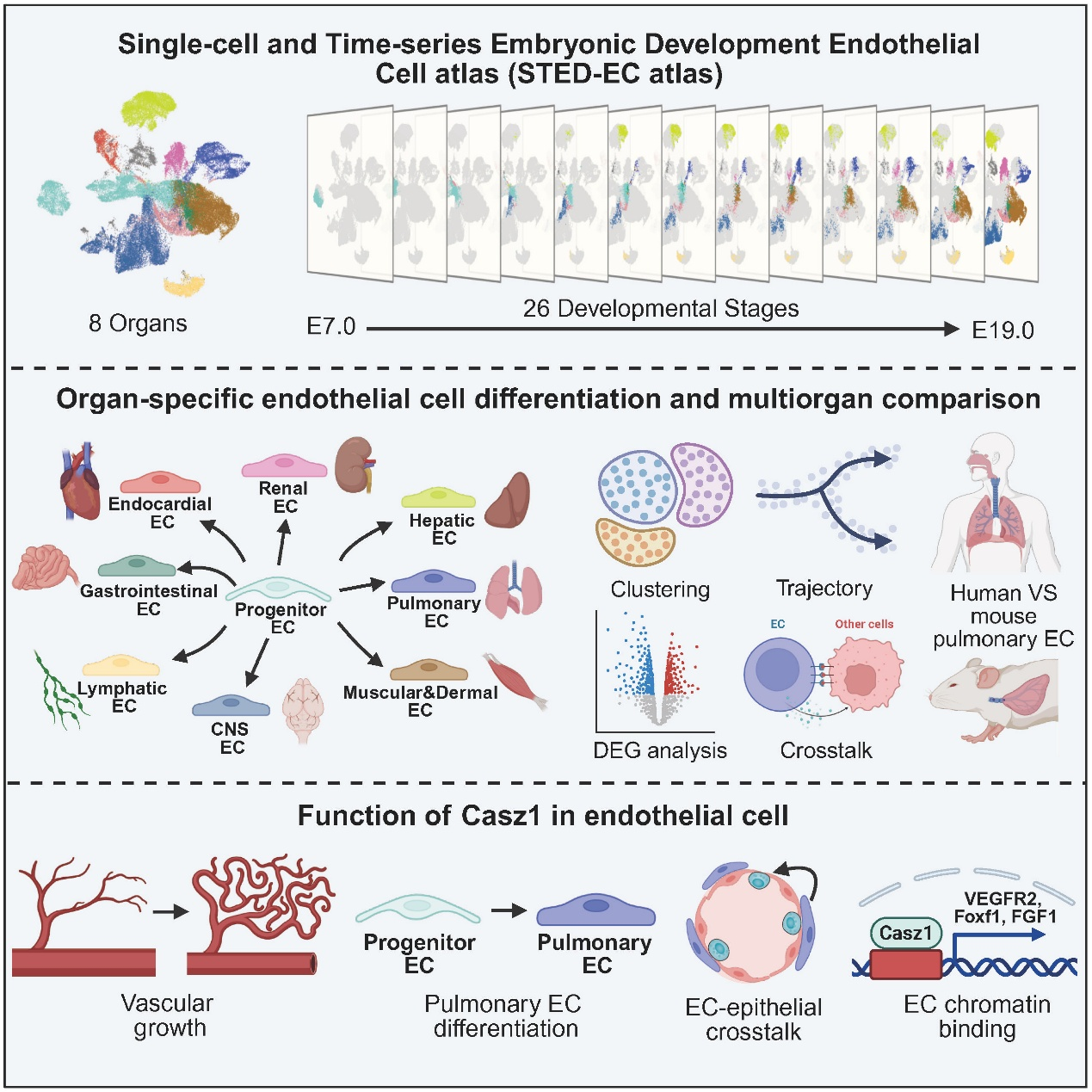
小鼠胚胎内皮细胞发育时空全景图(http://sted-ec.ccla.ac.cn/)
附件下载:



