科研进展
广州健康院在铜/手性磷酸催化的烯基异腈分子内还原(1+2)环加成反应取得进展
近日,中国科学院广州生物医药与健康研究院朱强/罗爽课题组通过铜/手性磷酸催化的烯基异腈分子内还原(1+2)环加成反应,对映选择性合成了多种含有N-H的2-氮杂双环[3.1.0]己烷化合物。相关研究以“Copper/Chiral Phosphoric-Acid-Catalyzed Intramolecular Reductive Isocyanide-Alkene (1 + 2) Cycloaddition: Enantioselective Construction of 2 Azabicyclo[3.1.0]hexanes”为题发表在《美国化学会志》(J. Am. Chem. Soc. DOI: 10.1021/jacs.4c00989)上。
2-氮杂双环[3.1.0]己烷骨架因其独特的结构优势,广泛应用在药物分子、生物活性分子以及有机合成领域,其中三元环的存在可以降低分子的亲脂性以及调节N-中心的碱性。目前这类骨架的合成主要方法有Simmons-Smith环丙烷化、Kulinkovich环丙烷化、钯催化分子内碳氢活化、以及分子内环异构化实现。但这些多数都集中在其消旋体的构建,以及N上通常需要保护。
近年来,Cu-H催化的烯烃的1,2-氢官能化反应取得了飞速的发展,尤其是在对映选择性氢胺基化领域,Buchwald课题组做了开创性且系统性的工作 (Acc. Chem. Res. 2020,53,1229−1243)。但与此形成鲜明对比的是,Cu-H催化的异腈的1,1-氢官能化反应模式相对单一,这主要是由于形成的甲酰亚胺铜中间体是亲核性的,只能发生亲核取代和亲核加成反应。在此前的报道中,一些过渡金属诸如Ni,Co,很容易与异腈配位形成亚胺金属络合物。在酸性条件下,这类物种更倾向于异构形成一类新型的氨基金属卡宾(Organometallics.,2003,22,2817−2819;Organometallics.,2021,40,968−978),但这类物种活性尚未被广泛研究。
受此启发,朱强/罗爽课题组设计了在铜/手性磷酸催化下,硅烷插入异腈形成的甲酰亚胺铜(I)物种可以有效地异构形成α-氨基卡宾铜中间体,从而与分子内烯烃发成(1+2)环加成反应。这种新型的环丙烷化方法可在空气和含水条件下进行,并以良好的产率和对映选择性合成结构多样化的含N−H的2-氮杂双环[3.1.0]己烷化合物。此外,含有两个手性中心的所有四个立体异构体都可以通过外消旋烯基异腈与构型相反的手性磷酸从两个平行动力学拆分反应中对映选择性的获得。目前该方法不仅为对映选择性构建2-氮杂双环[3.1.0]己烷及其衍生物提供了一种有效的方法,也证明了α-氨基卡宾铜中间体在不对称合成中的潜力。
广州健康院朱强研究员、罗爽研究员以及李婧博士为共同通讯作者,广州健康院2022级博士研究生程思迪为文章第一作者。该项目得到了国家自然基金、广东省自然科学基金、广西自然科学基金等项目的支持。
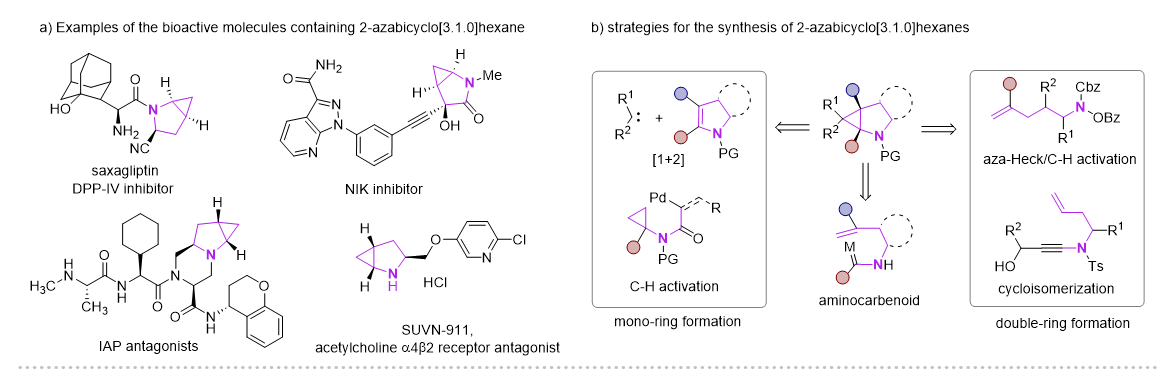
图1 2-氮杂双环[3.1.0]己烷化合物的应用及合成方法
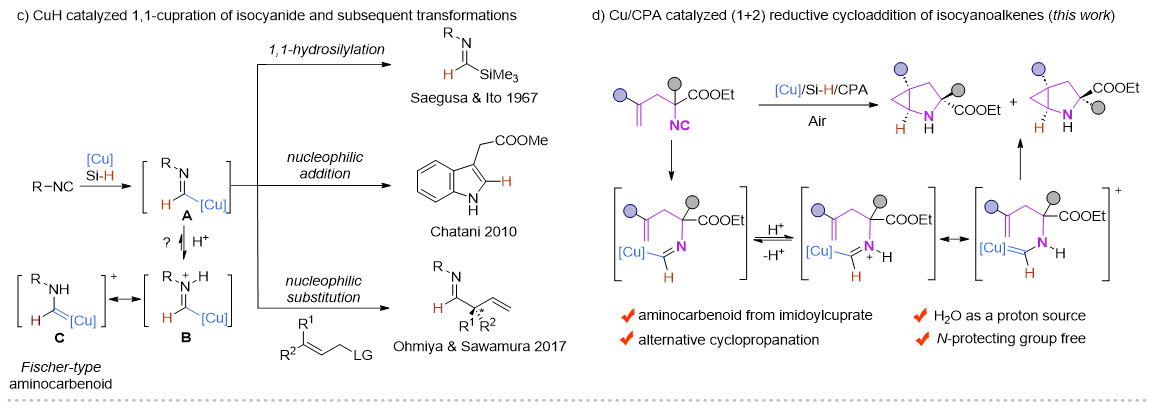
图2 实验设计
