

发布时间:2011-08-30



1. 会“变”的细胞——干细胞
·什么是干细胞?
什么是干细胞(stem cell)呢?简而言之,干细胞就是一类会“变”的细胞。
它们是这样一类细胞:
首先,它有无限的自我更新能力,可以在动物胚胎和(或)组织中一直分裂、并保持原本的未分化状态。就像孙悟空划去了生死簿上的名字以后,就再也不怕被阎王捉了。
其次,它具有分化的能力,也就是“变”的能力,在不同的培养条件下,它可以变成不同种类、具有不同功能的细胞。就像孙悟空,想变美女变美女、想变帅哥变帅哥、想变奥特曼变奥特曼!(不过不应该是干细胞它想变啥就变啥,而是科学家们想让它变啥就变啥,这可是研究干细胞的重要的热点领域噢!)
 干细胞就是会“变”的细胞
干细胞就是会“变”的细胞
最后,它是一类在细胞发育过程中处于较原始阶段的、尚未充分分化的、尚不成熟的细胞。就像菩提祖师给孙悟空起名字的时候说的那样:“狲字去了兽傍,乃是个子系。子者,儿男也;系者,婴细也。正合婴儿之本论。教你姓‘孙’罢。”越小越年轻越是有变化的能力。
总结一下,干细胞就是体内能“分”会“变”的“婴儿”细胞。
·干细胞的全家福
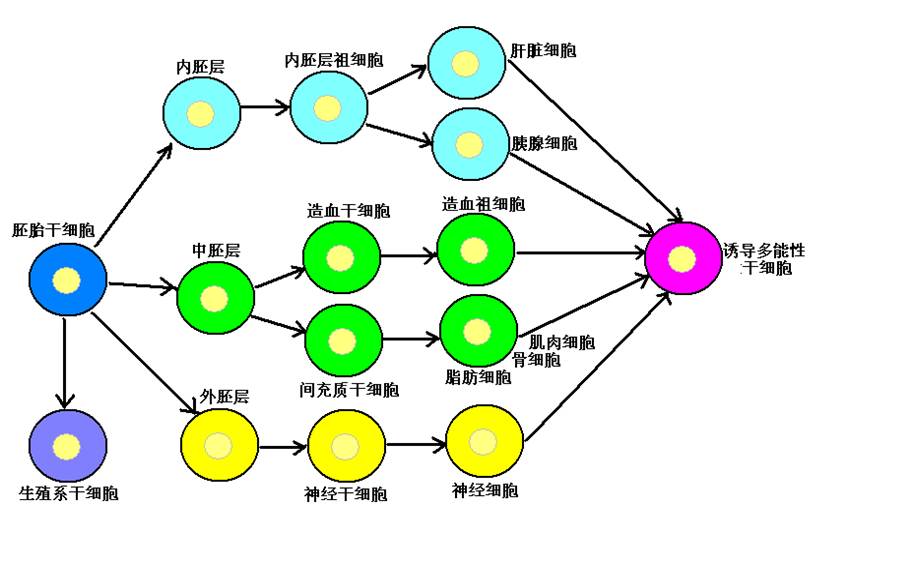
干细胞可是一个大家族,根据不同的分法可以分为以下几类:
首先,根据它的发育等级和分化能力,可以分为全能干细胞、多能干细胞和单能干细胞。
全能干细胞,顾名思义就是啥样的细胞都能变,嘻嘻,实际上不是的,光“啥都能变”有啥了不起的?全能干细胞的能耐可不止这么点!它的能耐是:它能形成一个新的生命个体。也就是说,从这一个细胞出发,经过分裂、增殖、分化最终可以得到一个完整的生物。这样的细胞对人体目前来说只有两种:一是,受精卵;二是,四分体时期的细胞(有的科学家认为桑椹胚时期的细胞也具备全能性,不过没有达成广泛共识)。可惜的是,这样的细胞太少了,而且以目前的科学技术还没有办法把它们分离出来传代培养(就是让它们不停的分裂还能保持原有的功能特点啦),所以我们实际上很少研究这一类的干细胞。
多能干细胞才是所谓的“啥都能变”的干细胞呢!为了区别期间,也有人把“啥都能变”的细胞叫“万能干细胞”,而把“能变很多种”的叫“多能干细胞”。“啥都能变”就是说人体的各种各样的细胞它都能变(当然要给它适当的环境),而“能变很多种”则是可以变成几种不同的细胞,但不是所有种类的细胞都能变,比如“造血干细胞”。但无论如何,它们可以变出不同的细胞、组织、器官,却没有办法形成一个完整的生物个体。
单能干细胞就悲剧了,它是只能变一种至多是两种细胞的干细胞,是干细胞中等级最低的一种,甚至被有“细胞种族歧视”的人不称其为“干细胞”,比如说“成肌细胞”啥的。其实人家还是具备一些干细胞的特性的,如自我更新能力、分化能力和相对的处于原始阶段(单能干细胞:“就是嘛!别拿村长不当干部!”)。
其次,根据干细胞的来源,我们还可以把它们分成胚胎干细胞和成体干细胞。最新的研究中还有一类新的干细胞,就是诱导多能性干细胞。
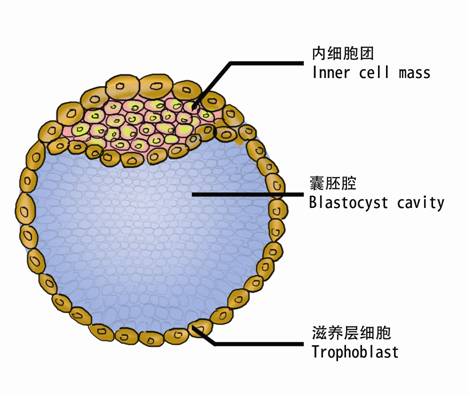
胚胎干细胞当然就是来自于胚胎的干细胞,实际上是来源于胚胎早期的干细胞。在胚胎的早期有一个阶段叫做胚泡,在这个阶段胚胎的样子像一个小泡泡,在这个小泡泡里有一小团细胞叫内细胞团,胚胎干细胞就是从这一小团细胞中分离出来的。胚胎干细胞是一类“万能干细胞”,它们具有分化成各种细胞类型的能力。
成体干细胞则是来源于成体的干细胞,它们根据组织来源的不同,又可以分为骨髓干细胞、神经干细胞、脐血干细胞、间充质干细胞等等,根据分化能力的不同,也可以分为造血干细胞、神经干细胞、肌肉干细胞、脂肪干细胞等等。其实同一种组织来源可以有多种不同分化能力的干细胞,比如骨髓和脐血里就都有造血干细胞和间充质干细胞,而功能不同的成体干细胞有时也会分化出相同的细胞,比如间充质干细胞和肌肉干细胞在一定的条件下可以分化成血细胞,这叫做干细胞的横向分化。
最后一种就是诱导多能性干细胞了。这可是近几年干细胞研究中最热的热点。这种细胞的来源是成体细胞,甚至是终末分化的细胞(也就是没有任何分化能力的细胞),比如胃腺细胞、淋巴细胞等,通过体外人工诱导的方法,比如用病毒给它插入几个基因之类,使它们回到最初的幼稚状态(返老还童?),重新具备了多能性,成为多能性细胞。这种细胞理论上讲是要与胚胎干细胞有着同样的功能和特点的多能性干细胞,只是来源有所不同罢了。
最近还有科学家天才地诱导成功了成体干细胞,就是用终末分化的细胞在体外诱导出来了具备分化成某种类型的细胞(心肌细胞)的干细胞,这也是一种诱导多能性干细胞。
·干细胞的“商标”
这儿存在一个问题,我们区分干细胞都是根据它们的分化能力来区分的。比如骨髓干细胞,这位说了,我从骨髓里拿出这么多细胞,看上去都差不多我怎么知道哪些细胞是可以分化的,哪些细胞不能呢?
所以我们就要给干细胞们都带上标签,也就是它们的“商标”。
以胚胎干细胞为例,鉴别它们的方法有很多,一步一步来:
首先,从长相上来看,胚胎干细胞还是有一定的特点的,比如细胞比较小,核比较大,核仁(在显微镜下能看到的细胞核内较致密的团块区域)比较明显,细胞排列致密(也就是挤在一起长啦),而且小鼠的胚胎干细胞团会长成一个一个小鼓包,就像纽扣一样;而人的则长成一个个小圆盘,和周围的细胞(滋养层细胞)有着比较明确的分界线。
其次,胚胎干细胞应该具有正常稳定的整倍体核型。这是什么意思呢?大家都知道绝大多数的动物的染色体数都是双数,染色体都是成对存在的。但是在人工培养的环境下,分离出的细胞的染色体往往会发生丢失,这儿丢一条、那儿丢一条;有时又会增加(在分裂过程中核物质没有平均分裂啥的);还可能有断裂了、重连了的,总之就是染色体不再是规规矩矩的双数的完整的了。这种情况在体外培养的肿瘤细胞中特别多见。但体外培养的胚胎干细胞却不能容忍这种情况的存在,胚胎干细胞必须是完完整整、漂漂亮亮的整倍体。
第三,端粒酶活性。有一种理论,认为人的终极预期寿命是120岁,这是怎么算出来的呢?它是通过计算人的细胞的分裂次数的极限算出来的,也就是说,人类细胞最多只能分裂50次。为什么呢?就是因为在人类染色体的末端有个叫端粒的区域,每一次分裂都会短一截,分裂50次就没有啦。而端粒酶则可以合成端粒的DNA序列。不过端粒酶只在生殖系细胞和胚胎组织中表达,所以胚胎干细胞里应该有高水平活性的端粒酶表达。
第四,细胞表面标志物。不同的细胞会表达一些不同的蛋白,如果这些蛋白主要表达在细胞膜上,使我们比较容易的能检测到,我们就叫它们“细胞表面标志物”。对于胚胎干细胞来说也是如此,比如人的胚胎干细胞就会表达阶段特异性胚胎抗原3(SSEA-3)、阶段特异性胚胎抗原4(SSEA-4)、高分子量糖蛋白TRA-1-60和TRA-1-81、以及最常见的碱性磷酸酶(AP)等。此外,一些不是在膜上表达,但在胚胎干细胞中比较特异性的高表达的蛋白,也被用于鉴定胚胎干细胞,比如:Oct4、Sox2、Nanog等等。

最后,鉴定一株培养的细胞是否是胚胎干细胞的最终的标准(金标准)是看它有没有分化潜能。一种方法是将胚胎干细胞皮下注射到免疫缺陷(也就是没有或只有很弱免疫排斥能力)的小鼠体内,比如SCID-bg小鼠,如果这些细胞可以在这样的小鼠体内发育形成有三个胚层成份的畸胎瘤,那么就说明了这株细胞具有“多能性”,是实至名归的“胚胎干细胞”。另外,也可以在体外培养,鉴定分化潜能。实际上,当改变培养环境时,比如去除滋养层细胞(胚胎干细胞喜欢长在某些其他种类的细胞上,这些细胞就好像是胚胎干细胞的保姆)、或者不再在培养基内加入某些生殖因子如白血病抑制因子时,胚胎干细胞就会自发的发生分化,形成类胚体,若将类胚体进一步分化,就可以形成许多种不同的细胞,如造血、内皮、神经和肌肉谱系的细胞,通过检测成体细胞的特异性细胞表面标志物,就可以成功的把它们鉴定出来了。
看到了吧?干细胞的鉴定是一个非常复杂而细致的工作,科学研究就是这样,绝大多数都是艰苦细致无聊的重复劳动,真正激动人心的时刻并不多。但是没有这些艰苦细致的工作,也就不会有真正激动人心的时刻了。
2 干细胞有啥用?
·干细胞的强大功能
就像孙悟空一样,干细胞本事大,所以就非常有用,可以用于医学和基础研究的很多个领域。不过离现实最近的,还是再生医学。就是以干细胞为“种子”,培育出器官组织等,来替换被损伤的、自身病变或衰老的器官组织。所以,美国《科学》杂志1999年将干细胞研究列为世界十大科学成就的第一,排名尚在人类基因组测序和克隆技术之前。
最早的干细胞治疗开始于骨髓移植,早在20世纪60年代就已经开始了实验性治疗,到70年代,异体骨髓移植已经在治疗血液系统疾病中得到了广泛利用。但是因为配型不易,骨髓资源稀缺,真正能够得到救助的病人还是少数。20世纪80年代,开始出现了自体造血干细胞移植的研究,就是先用化疗药物清除病人体内残存的癌细胞,然后再将事先提取的病人自己的骨髓细胞分选出“好”的细胞,采用特殊的培养体系,选择性的让正常的造血细胞生长,重新移植回病人的体内。这样,虽然复发率较异体移植要高一点,但不存在配型和骨髓来源问题,所以得到了广泛的应用。自体骨髓移植不仅可以用于治疗白血病,还可以用于淋巴瘤和某些实体瘤的治疗。
随着医学研究的深入和医学科技的发展,之后又出现了外周血造血干细胞移植和脐带血造血干细胞移植。前者是利用药物,让本来待在骨髓等边缘池(造血干细胞休息的地方)的造血干细胞跑到血液中,然后再用特殊的机器将它们分离出来,用于移植。后者,则是在胎儿分娩时将脐带里的血液保存下来,因为脐带血细胞幼稚程度低,免疫原性也低(就是不易引发免疫反应),所以不但可以用于自体移植(保存在脐血库,需要用时再拿出来),还可以用于异体移植(造福他人)。在以后的章节中我们会分别对这些应用做一些介绍。
美国杰龙生物医药公司(Geron Corporation)2010年10月11日宣布,佐治亚州亚特兰大“牧者中心”医院已于2010年10月8日利用该公司培植的GRNOPC1人类胚胎干细胞,展开全球首宗人类胚胎干细胞治疗的人体临床试验。
[延伸阅读] 在我国,20世纪60年代就开始了骨髓干细胞移植方面的研究;1992年第一个骨髓移植非亲属供者登记组在北京成立,“中华骨髓库”正式接受捐赠(2000年11月改名为中国造血干细胞捐献者资料库);2002年,北京建立了脐带血干细胞库;2009年上海成立了国家干细胞工程技术研究中心医学转化基地。干细胞技术的研究已经进入了临床应用的阶段。 目前研究中应用干细胞治疗的疾病主要有: 神经系统:阿尔茨海默病、帕金森病; 血液:白血病、镰状细胞贫血症、地中海式贫血; 心脏:心肌梗塞; 骨组织:软骨缺损、退化性关节炎; 肌肉:肌营养不良症; 胰脏:糖尿病; 肝脏:肝炎; 皮肤:烧伤; 脊椎:脊椎损伤,等
·干细胞的使用规范
利用干细胞进行再生医学的研究与治疗,有的是用体细胞在体外培养后再植入人体为主的细胞治疗产品、还有单纯的移植用人体细胞或组织,甚至还有结合生物基质、人体细胞与生长因子于一身的组织工程医疗产品,它们都是人体细胞组织产品。它们根据来源不同,又可以分为:自体、异体和异种移植产品。
这些来源于人体的细胞组织产品的生物学特性千差万别,而从药品、医疗器材的角度讲,也与其他的药品、医疗器材完全不同。鉴于目前世界上干细胞治疗领域的迅速发展,美、欧各国都已经先后研究评估出了各自的管理机制。首先,是根据人体细胞组织产品的生物学特性来对产品进行分级和分类;其次,就是对这些产品的人类传染病及其病原体的筛查与监控,以及在处理过程中确保不受微生物污染。
总的来说,以干细胞为主的用于再生医学的人体细胞组织现在已经成为了一类“产品”,正在走向产业化道路,对这一类产品的监控,已经在各国法律中提到了议事日程上来了。
对于我们普通老百姓来说,我们所要知道的就是,从正规来源获得的用来修复我们的组织器官的无论是干细胞还是用干细胞构建的组织、器官,都是在国家的严密监控之下,有严格的法规规定的,其安全性和可靠性还是可以信赖的。
还有一点是,一旦一类科学研究走上了产业化之路,那就是说它走上了发展的快车道,在利益的驱使下,这项研究将不只是国家资助下的实验室研究,而会扩展到商业和工业领域,这无疑是广大患者的福音,再生医学的发展将大有可为。
附件下载:



