

发布时间:2025-04-01
近日,中国科学院广州生物医药与健康研究院等机构在Cell Reports Medicine发表题为“CD4+ anti-TGFβ CAR T cells and CD8+ conventional CAR T cells exhibit synergistic antitumor effects”的研究论文。该研究首次证实CD4+靶向TGFβ的CAR-T细胞(T28zT2 T细胞)与CD8+靶向GPC3或MSLN的CAR-T细胞联合应用具有协同抗肿瘤效应,为实体瘤免疫治疗提供了全新策略,并同步启动针对肝癌和胰腺癌等实体瘤的相关临床研究(NCT03198052)。
TGFβ1是肿瘤微环境中的关键抑制性因子,可抑制CD4+ T细胞、CD8+ T细胞及NK细胞的效应功能。然而,TGFβ1也能够通过促进CD8+ T细胞重编程为组织驻留记忆T细胞(Trm细胞),增强其续存和定植能力。这表明TGFβ信号具备高度的亚群依赖性,即可作为抑制性因子,也能通过特定途径重塑T细胞功能。
研究团队研发了一款新型靶向TGFβ的CAR-T细胞(T28zT2 T细胞),通过中和TGFβ信号逆转肿瘤微环境中的免疫抑制,并展现出显著的抗肿瘤潜力。研究发现,CD4+ T28zT2细胞在TGFβ1刺激下可在血液和肿瘤中长期存活,并分泌Granzyme B和IFN-γ直接杀伤肿瘤;而CD8+ T28zT2 T细胞则未显示同等抗肿瘤效应。进一步分析表明,肿瘤浸润的CD4+ T28zT2细胞高表达TCF-1、IL7R和CXCR3,呈现记忆样T细胞特征,同时上调NKG2D并降低PD-1/LAG3等耗竭标志物,显著增强其抗肿瘤活性。此外,CD4+ T28zT2细胞能够重塑肿瘤微环境,协同增强靶向GPC3或MSLN的CD8+ CAR-T细胞的抗肿瘤能力,呈现倍增效应。
机制研究揭示,CD4+ T28zT2细胞通过阻断TGFβ1诱导的线粒体分裂和膜电位抑制维持效应功能,同时通过CXCR3高表达促进肿瘤浸润,NKG2D的上调则精准递送杀伤因子以避免全身毒性。基于这一突破,团队已启动相关临床研究(NCT03198052),旨在评估“CD4+靶向TGFβ CAR-T联合CD8+靶向MLSN或GPC3 CAR-T”治疗恶性实体肿瘤的安全性和有效性。该疗法有望突破目前实体瘤CAR-T细胞疗法响应率低、复发率高的瓶颈,推动CAR-T细胞疗法在实体瘤领域的临床转化。
广州健康院李鹏研究员为论文的唯一通讯作者。中国科学院香港创新研究院再生医学与健康创新中心郑迪威博士、广州健康院秦乐副研究员为共同第一作者。研究项目得到了国家重点研发计划、国自然以及GIBH自主部署项目等经费的支持。
论文链接
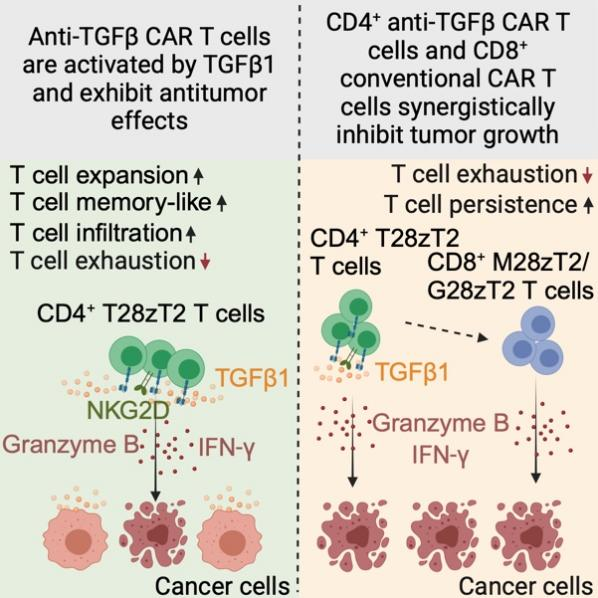
图1 CD4+靶向TGFβ CAR-T细胞具备杀伤癌细胞和协同抗癌双重作用
附件下载:



