

发布时间:2022-05-30
5月25日,Cell Death & Differentiation在线发表了中科院广州生物医药与健康研究院刘兴国团队的最新研究成果“Plin2-mediated lipid droplet mobilization accelerates exit from pluripotency by lipidomic remodeling and histone acetylation”(Plin2介导的脂滴动员通过脂质组重塑及组蛋白乙酰化加速多能性退出)。该研究发现多能干细胞分化伴随着脂滴消失,过高的脂质水解引起脂质组重塑,从而调控线粒体关键磷脂及内嵴结构,进一步通过降低乙酰辅酶A及组蛋白乙酰化,最终促进多能性的退出。这一工作不仅揭示了脂滴稳态在多能性维持中的作用及其调控蛋白,还发现了脂滴-线粒体互作调控表观遗传及细胞命运的新模式。
细胞器及代谢重塑在干细胞命运决定中起着重要作用,不仅提供代谢底物,还可参与调控表观遗传及基因表达。多能干细胞具备独特的细胞器结构和代谢模式,而细胞器及代谢逐渐被认为是调控细胞命运的关键调控因子。刘兴国团队在国际上独辟蹊径,系统的阐明了细胞器的离子信号,组分重塑,代谢组-表观组,乳酰化及磷酸化修饰,脂代谢通路等调控多能性的一系列重要方式。
脂滴是一种进化上高度保守的细胞器,由单层磷脂膜包裹核心的中性脂组成,参与脂质的储存和利用。许多哺乳动物的卵细胞和胚胎中存在大量脂滴,其形态数目随着卵裂及胚胎发育发生剧烈变化,然而脂滴稳态在多能干细胞命运决定中的调控模式及作用仍不清楚。
刘兴国团队发现胚胎干细胞 (embryonic stem cell, ESC) 存在大量脂滴,维持着较低的中性脂水解速率,而多能干细胞分化伴随着中性脂水解速率的上升及脂滴的消失。这一分化中的脂质变化受分子伴侣介导的自噬调控:多能干细胞分化起始时,脂滴表面蛋白Plin2被分子伴侣Hsc70识别并转运至溶酶体降解,加速了脂滴中性脂的水解。进一步机制研究发现,过高的脂质水解速率引起细胞内脂质组的重塑,降低线粒体中的关键磷脂-心磷脂与磷脂酰乙醇胺,破坏线粒体内嵴结构,从而降低脂肪酸氧化及乙酰辅酶A的产生。乙酰辅酶A的降低引起多能性相关基因启动子上组蛋白乙酰化H3K27ac的降低,加速了多能性相关基因的下降及多能性的退出。
该研究揭示了“脂滴涅槃”燃烧自己,而照亮多能干细胞分化进程的功能,发现脂滴稳态与线粒体重塑的互作新模式。由于脂滴变化及线粒体重塑存在于许多生理病理过程中,包括胚胎停滞,肿瘤发生,脂肪肝及神经退化等,这一工作为探索这些生理病理过程的机制提供了全新的思路。
“轻轻的我走了,正如我轻轻的来”,多能性与脂滴一路陪伴,而多能性退出时,脂滴也“涅槃”消失,起始分化为各胚层的发育进程,正是“相见时难别亦难,由一生二万物元”。脂滴的消失,通过细胞器互作重塑线粒体磷脂组分与内嵴重塑,正是“脂滴涅槃聆旧梦,线粒漫溯唤新颜”。 进一步乙酰辅酶A通过组蛋白乙酰化加速多能性的退出,正是“笙箫空余何寂寞,星船满载是乙酰”。这一发现对于胚胎早期发育具有重要的生理意义,然而,当人生到达“四十而不惑”的油腻中年,脂滴在肝脏、肿瘤、退化神经等又重现,这一发现同样具有重要的病理意义,正是“此别可待成追忆?人生不惑如初见。”
本研究与复旦大学及香港中文大学合作完成。获得国家重点研发项目、国家自然科学基金、中科院、广东省、广州市等的经费支持。
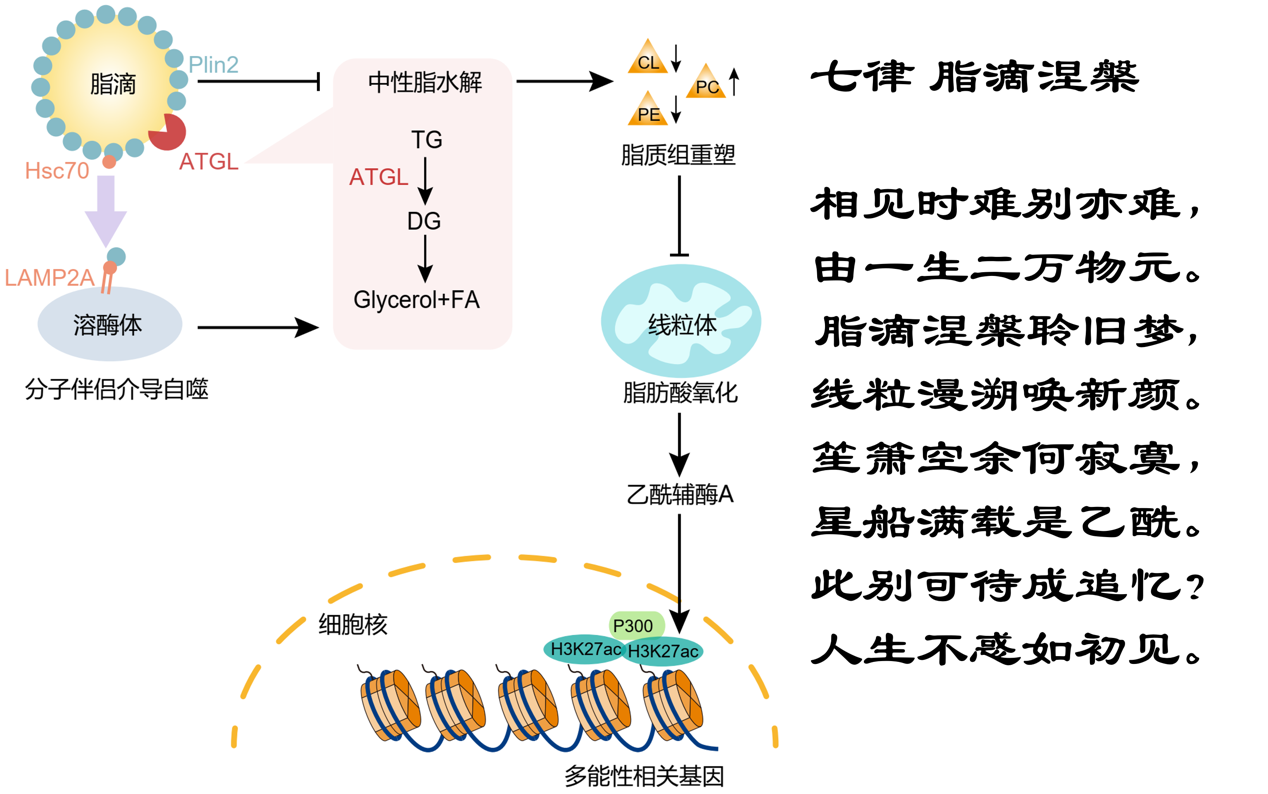
脂滴-线粒体互作调控表观遗传及细胞命运的模式图
附件下载:



