

发布时间:2022-03-15来源:供稿:陈奇
近日,中国科学院广州生物医药与健康研究院等单位合作在实验动物研究中发现,造血干细胞发育过程中,动脉血管调控造血干细胞首次进入胚胎期骨髓。相关成果以“A specialized bone marrow microenvironment for fetal haematopoiesis”为题于2022年3月14日在线发表在Nature Communications杂志上。
造血干细胞(Hematopoietic Stem Cell, HSC)具有分化为几乎所有血液细胞的多能分化潜能,因此在放化疗后进行造血干细胞移植,已广泛应用于多种恶性血液疾病的治疗。对造血干细胞植入骨髓机制的研究,有助于提高造血干细胞移植效率。
在成年哺乳动物体内,造血干细胞主要存在于骨髓中。造血干细胞的维持、静息和增殖等行为受到其微环境的调控。成年动物骨髓中造血干细胞和骨髓微环境的相互作用,已被较深入研究。但胚胎期骨髓微环境如何调控造血干细胞的行为仍不清楚。
这项研究利用遗传操作小鼠通过单细胞测序对比分析发现,造血干细胞和骨髓微环境在胚胎期与成年期差异巨大,动脉血管在胚胎骨髓中非常重要。在小鼠胚胎发育第16.5天,绝大多数造血干/祖细胞都位于动脉血管旁。研究者发现此时的骨髓动脉可以释放Wnt2,动脉来源的Wnt信号影响造血干/祖细胞的扩增。而利用重组蛋白Wnt2在体外处理造血干/祖细胞,可以促进造血干/祖细胞的增殖、增强造血干/祖细胞形成体外克隆的能力。
该工作由德国马克思普朗克分子生物医学研究所,与华南理工大学医学院和广州健康院合作完成。广州健康院细胞谱系与发育研究中心陈奇研究员是本项工作的共同第一作者。这项研究得到中国科学院广州生物医药与健康研究院,中国科学院再生生物学重点实验室和广东省干细胞与再生医学重点实验室等方面的资助。
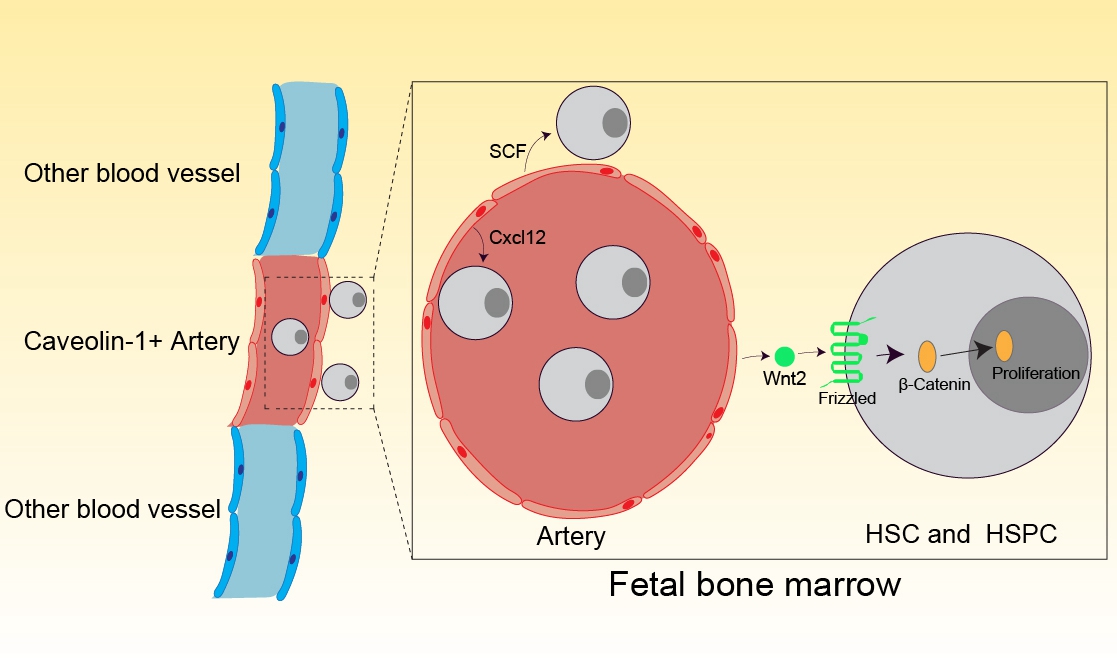
工作示意图:造血干/祖细胞通过动脉进入骨髓
附件下载:



