

发布时间:2021-12-20来源:供稿:杨乐乐
12月17日,中国科学院广州生物医药与健康研究院戚华宇课题组研究揭示了核糖体蛋白通过调控蛋白翻译机器和蛋白质量控制维持小雄性生殖细胞发育的作用,相关成果以Proteostasis regulated by testis-specific ribosomal protein RPL39L maintains mouse spermatogenesis为题在线发表在iScience。
哺乳动物雄性配子-精子-是传递遗传物质、维持与繁衍物种以及进化的基础。由于精子发生具有周期性、长期性和受动物体内、外环境因素影响等特点,精子质量的控制与遗传疾病的发生、生殖健康等具有密切的关系。成年动物,包括人类,在急性损伤(如癌症的化学和放射性治疗)和年龄的增长等条件下,生殖细胞发育潜力与功能往往衰退并伴随基因组的遗传变异,不但造成生殖健康、疾病等问题,而且可通过遗传或表观遗传的方式影响下一代的健康。如何诊断、治疗相关疾病和健康问题,改善和提高生殖细胞功能是大众所关注的问题;由于生殖细胞是动、植物体中唯一在亲子代间延续生存的细胞类型,对生殖细胞发育调控机制的基础研究也在发育、干细胞、再生与衰老等领域具有广泛的影响。
成年动物的精子发生起始于精原干细胞,经历有丝分裂、减数分裂和细胞的形态发生等阶段。近年来研究指出,小鼠及人类基因组中有90%以上的基因在雄性生殖细胞的发育过程中将经历表达、沉默等的调控,在多数发育阶段有数千种不同蛋白的翻译发生。生殖细胞在不同发育阶段如何选择发育与功能的调节方式?研究组在前期研究中发现部分RNA结合蛋白特异性地富集于精原干细胞中,包括核糖体亚基蛋白,如:RPL39L。通过小鼠遗传学、细胞生物学以及生物化学等实验,研究人员发现特定核糖体蛋白对细胞中蛋白翻译机器具有非组成型(constitutive)的调节(regulatory)作用:RPL39L的缺失造成了进入分化阶段的精原干细胞的发育障碍,并在后续发育过程中对精子细胞的数量和质量产生影响。进一步研究发现,虽然缺少RPL39L的核糖体依然可担负信使RNA的翻译作用,但细胞中蛋白合成的效率、新生蛋白的质量均受到负面影响,产生的精子由于线粒体结构和功能的障碍缺少运动性能。在对小鼠中雄性性腺的化学损伤模型的分析中,研究人员发现,生殖细胞蛋白组稳态的异常影响了生精细胞的再生,并使得成年动物的精子发生过程产生退行性变化。
上述研究揭示了核糖体蛋白不仅可做为细胞中蛋白翻译机器的组成部分,且具有调节核糖体产生和新生蛋白质量控制的作用。实验结果也揭示了生殖干细胞在自我更新与分化时对细胞中蛋白合成调控作用的不同依赖性,为深入研究细胞中的功能单位-蛋白质-合成在细胞命运变化和相关组织再生的问题提供了基础。
核糖体蛋白在不同细胞中具有表达的异质性,然而它们对蛋白合成的调节作用目前仍不完全清楚。在对RPL39/RPL39L同源蛋白的研究中,研究组在早前的研究中,发现它们或具有功能上的同源性,并可偶联线粒体功能促进细胞的增殖生长。 相关研究结果也于近期发表于International Journal of Biochemistry and Cell Biology (2021 Oct,139:106070.doi:10.1016/j.biocel.2021.106070)。
研究得到国家卫计委重点研发计划生殖健康及重大出生缺陷防控研究专项、中国科学院再生生物学重点实验室、广东省干细胞与再生医学重点实验室、广东省自然科学基金委、广州生物岛实验室前沿探索项目以及中国科学院广州生物医药与健康研究院等的支持。相关实验得到张小飞课题组和广州生物岛实验室蛋白质中心的合作与帮助。
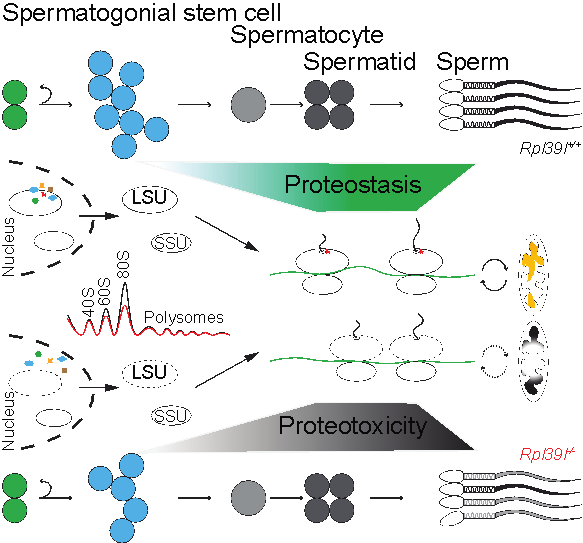
核糖体蛋白RPL39L调节蛋白组稳态维持生精细胞发育
附件下载:



