

发布时间:2021-09-02来源:供稿:刘兴国
8月31日, Science China Life Sciences(《中国科学》英文版)在线发表了中国科学院广州生物医药与健康研究院刘兴国团队的最新研究成果“Short-form OPA1 is a molecular chaperone in mitochondrial intermembrane space”的研究论文,该研究报道了在线粒体这一双膜细胞器中,内外膜之间的膜间隙是来自呼吸链多重损伤的最恶劣胁迫区域,而OPA1的可溶性短链蛋白在这一区域起到分子伴侣(molecular chaperon)帮助蛋白折叠这一全新功能,对于维持线粒体稳态发挥重要作用。
线粒体是真核细胞中的重要细胞器,其如何调控细胞核一直是亟待回答的基本科学问题。刘兴国博士团队在国际上独辟蹊径,从新颖的视野揭示了线粒体氧离子调控组蛋白与DNA甲基化(Liu X*, 2016, Cell Metab; Liu X*, 2018, Cell Metab),代谢产物调控组蛋白乙酰化与乳酸化 (Liu X*, 2020, Nat Metab)、磷脂调控基因表达(Liu X*, 2019, Sci Adv)等全新反向信号模式。而线粒体反向信号中,线粒体未折叠蛋白反应 (mitochondrial unfolded protein response, mtUPR) 是用于控制错误折叠蛋白质的质量控制途径。线粒体未折叠蛋白反应,通过细胞核激活线粒体基质内几种分子伴侣和蛋白酶的表达,以响应在胁迫条件下线粒体内错误折叠蛋白质的出现,协助达到或恢复到其自然状态。然而,线粒体内外膜之间的膜间隙是最严重的氧化胁迫环境,受到呼吸链造成的多重损害,在这一区域存在怎样的分子伴侣是至关重要的科学问题。
刘兴国团队发现线粒体内膜融合蛋白OPA1,胁迫条件下在膜间隙剪切而成的可溶性短链蛋白(S-OPA1),作为膜间隙的分子伴侣,用于维持膜间隙的蛋白稳态。首先在体外纯化了可溶性短链形式的S-OPA1蛋白,表明它保护底物蛋白免受热和化学诱导的聚集,并提高了细菌对于热刺激的抗性。进一步的体内工作利用OPA1基因敲除的细胞及回补可溶性短链形式的S-OPA1蛋白,确定其在热刺激下保护线粒体膜间隙蛋白,并结合质谱分析及免疫共沉淀技术,发现溶神经素是其保护蛋白之一。
线粒体在细胞内具有相对较高的温度,比周围环境高约 10°C,而其膜间隙是其中高温、氧化、PH胁迫条件最恶劣的区域,可谓“水深火热”。与其它细胞区域相比,用于帮助蛋白折叠的热休克蛋白家族,如Hsp60 和 Hsp70,尚未在线粒体膜间隙中被鉴定。因此,刘兴国团队发现S-OPA1 对膜间隙蛋白在胁迫条件下聚集的抑制功能,对保护线粒体蛋白的稳态维持具有重要意义。
OPA1(Optic Atrophy 1,视神经萎缩蛋白1)在多种生理病理中发挥重要作用,刘兴国博士对OPA1在线粒体抗胁迫的作用进行了系统研究,这一持续的工作使人们对于OPA1在线粒体损伤中的“三头六臂”的多重作用有了一个崭新并全面的认识:首先,当线粒体在胁迫条件下时,其膜间隙的可溶性短链蛋白S-OPA1作为分子伴侣,发挥“仁义”的作用,维持线粒体蛋白稳态;其次,当线粒体通过社交得到外援而功能恢复,OPA1不含外显子4b的剪接体发挥了“情商”的决定作用,可以与其他功能正常的线粒体进行“kiss-and-run”或完全融合得到恢复(Liu X et al., 2019, EMBO J);再次,当线粒体自我功能恢复,OPA1含外显子4b的剪接体发挥了“良知”的启动作用,特异结合线粒体DNA的转录的调控区而恢复功能(Liu X*, 2020, Front Cell Dev Biol);最后,当线粒体损伤严重将导致细胞死亡,OPA1则骤然“心碎” 释放内嵴的细胞色素c引发凋亡(Liu X*, 2015, Heptology)。
本研究获国家重点研发项目、中科院、国家自然科学基金、广东省和广州市的经费支持。
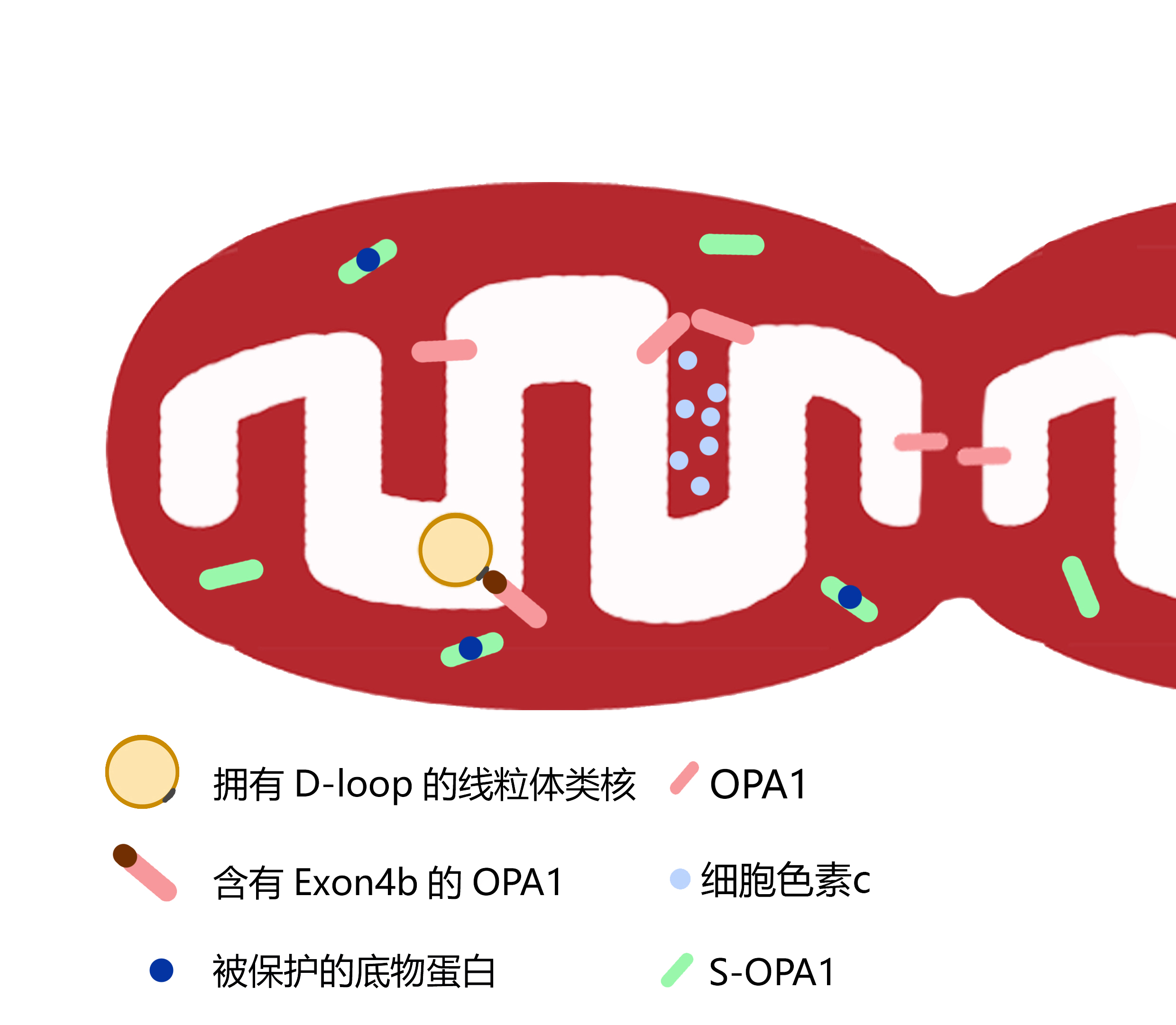
OPA1在线粒体的多种功能
附件下载:



