

发布时间:2021-07-06来源:供稿:匡俊企
多能性状态的退出或多能性细胞-体细胞转变是哺乳动物胚胎发育过程的重要事件,也是细胞命运决定研究的热点领域。越来越多的证据表明该过程被高度调控,而非一个被动的事件,但其背后的分子机制还存在大量未知。
近日,中国科学院广州生物医药与健康研究院刘晶课题组和西湖大学裴端卿课题组合作,基于cJUN诱导小鼠胚胎干细胞多能性细胞-体细胞转变细胞模型,发现了染色质重塑复合物BAFs(Brg/Brahma-associated factors)的亚基SS18 通过本身相分离性质显著调控这一过程,该成果以” SS18 regulates pluripotent-somatic transition through phase separation”为题于7月2日在线发表在Nature Communications(《自然·通讯》)杂志上。
团队早期发现原癌基因cJUN 可快速诱导多能性状态的退出(Jing Liu et al, Nature Cell Biology, 2015),基于此研究人员构建了可诱导多能性细胞-体细胞转变细胞模型。进一步,通过基于CRISPR/Cas9的全基因组基因敲除的遗传学筛选技术确认了一系列候选基因,发现其中SS18基因的失活会在转录组、克隆形成能力及干细胞克隆形态等方面显著延迟多能性体细胞转变进程。同时,SS18的功能也能够在其他多种多能性退出体系中得到验证。
科研人员深入研究发现,SS18蛋白在体内可以发生液液相分离(Liquid-liquid Phase Separation, LLPS),表现在1、SS18蛋白可以在细胞核内通过分子间弱相互作用形成微米级凝聚体;2、凝聚体内部以及凝聚体内和凝聚体外物质可以进行交换;3、凝聚体可以发生融合和分裂行为,且融合分裂时间与凝聚体大小成正比。SS18的液液相分离能力依赖于位于其羧基端的内在无序区(Intrinsically Disordered Region, IDR),其中高度富集的酪氨酸发挥着核心作用,酪氨酸的突变会导致SS18蛋白无法形成凝聚体,同时也使得SS18失去调控多能性退出的能力。进一步研究人员还发现, SS18的IDR可被来自于其他蛋白的富含酪氨酸IDR(如FUS和TAF15)及多聚酪氨酸多肽所替代,而非酪氨酸富集的IDR(如BRD4及MED1)则不能进行功能替代。
针对SS18的相分离行为是如何调控多能性退出的具体机制,科研人员进一步展开了深入的机制研究。已有研究表明SS18蛋白是染色质重塑复合物BAFs的稳定亚基。在胚胎干细胞中,BAFs主要分为三种亚型:经典BAF(canonical BAF, cBAF)、非经典BAF(non canonical BAF,ncBAF)以及PBAF(Polybromo-associated BAF)。他们含有一些共有成分如SMARCD1以及BCL7A/B/C等,也分别含有其特异性亚基。科研人员发现,SS18形成的蛋白凝聚体可以富集cBAF特异性亚基而排斥PBAF特异性亚基,从而起到促进或抑制相应BAF亚型装配的功能,而不同亚型的BAFs在多能性体细胞转变中的角色却不尽相同。因此,SS18蛋白的缺失会打破BAFs各亚型之间装配的平衡,并最终影响多能性细胞-体细胞转变进程。
本研究揭示了相分离在染色质重塑复合物装配过程中的重要作用,丰富了人们对于细胞命运转变在不同层级上进行调控的认识,对于深入研究BAFs复合物在发育、细胞命运转变以及肿瘤发生发展中的作用都具有借鉴意义。
该论文是在西湖大学裴端卿研究员和广州健康院刘晶研究员的共同指导下完成,广州健康院博士生匡俊企和硕士翟梓蔚为共同第一作者。广州健康院陈捷凯研究员和张小飞研究员对该工作进行了重要的指导和支持。本项工作得到了国家自然科学基金、国家重点研发计划,中国科学院“战略性先导科技专项”、中国科学院前沿科学重点研究项目、广东省科技计划项目、生物岛实验室前沿探索项目等的经费支持。
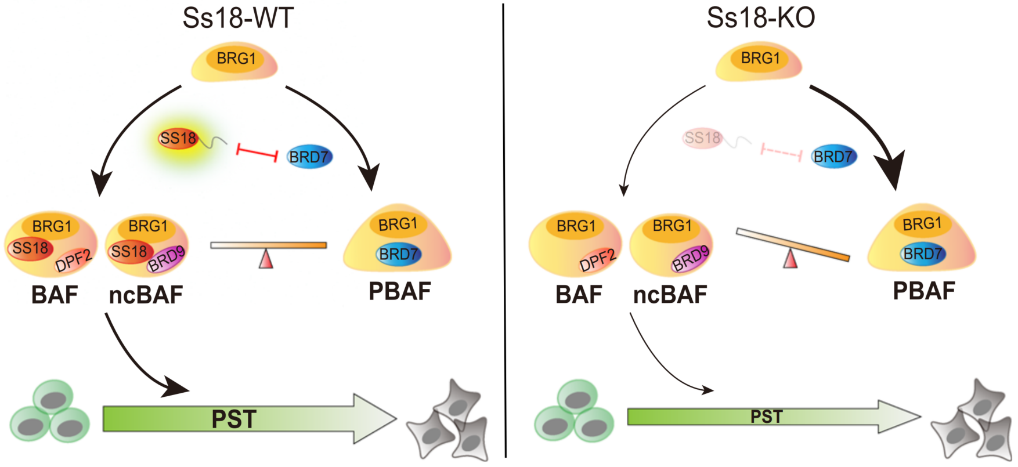
多能干细胞-体细胞命运转变新机制
附件下载:



