

发布时间:2017-01-20来源:供稿:干细胞所 李欢欢
1月19日,国际学术期刊《细胞干细胞》(Cell Stem Cell)在线发表了中国科学院广州生物医药与健康研究院姚红杰课题组的最新研究成果(RNA Helicase DDX5 Inhibits Reprogramming to Pluripotency by miRNA-based Repression of RYBP and its PRC1-dependent and -independent Functions)。该文章首次揭示了RNA结合蛋白(RBP)DDX5对体细胞重编程的重要作用和调节机制,这将加深人们对RBP介导细胞命运决定的认识。
RBPs不仅在维持细胞内稳态有重要的功能,在分化和维持细胞特性等方面也发挥着重要作用。尽管RBPs功能的多样性和必要性几乎涉及了RNA代谢的所有过程,但RBPs在细胞命运转变中的机制有待进一步研究。2006年,日本科学家山中伸弥成功建立了诱导多能干细胞(iPSCs)技术,实现了将成体细胞转化为具有多种分化潜能的iPS细胞,对临床医学具有指导意义,山中伸弥因此获得了2012年诺贝尔生理学或医学奖。然而,体细胞重编程是一个非常复杂的过程,必需克服重重障碍,才能抵达终点,成为具有干性的细胞。近年来研究者们热衷于探索其中的阻碍因素,表观遗传是其中一个重要的因素。对于DNA甲基化修饰、组蛋白修饰、microRNA等表观遗传修饰以及转录因子调控体细胞重编程的研究已有很多的报道,但是RBPs在细胞命运转变,尤其在体细胞重编程过程中所发挥的功能还不为人所知。
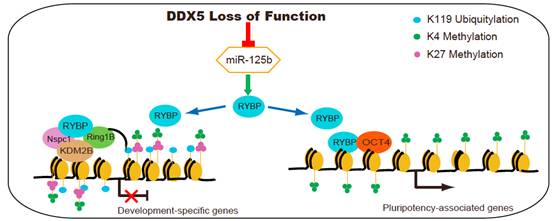
姚红杰课题组研究发现,重编程过程中,虽然RBP DDX5的表达逐步上升,但却发挥着抑制重编程的作用。DDX5功能缺失通过影响微小RNA(microRNA)125b的表达水平,从而上调非经典PRC1复合物里的RING1和YY1结合蛋白(RYBP)的表达水平。DDX5功能缺失和RYBP过表达在重编程早期影响间质细胞向上皮细胞转变,在重编程晚期影响多能性基因的激活。研究发现,DDX5功能缺失上调RYBP,从而进一步促进了组蛋白H2A赖氨酸K119位点的泛素化(H2AK119ub1)的水平,并促进H2AK119ub1富集到部分胚层分化特异基因的转录起始位点上,并抑制这类基因的表达。
研究团队进一步发现,RYBP存在于两个完全不同的复合物中,一部分RYBP与多梳抑制复合物1(PRC1复合物)存在于同一个复合物中,可能发挥抑制部分胚层分化基因的作用;而另一部分RYBP与多能性因子OCT4存在于同一个复合物,发挥基因激活的作用。此外,科研人员发现,RYBP在基因组中的结合位点有很大一部分与OCT4的结合位点相重叠,而且RYBP有利于招募OCT4到组蛋白去甲基化酶基因Kdm2b的启动子区,并激活内源多能性基因的表达从而促进体细胞重编程,此功能是PRC1非依赖性的。
该研究揭示了RBP DDX5在调节体细胞重编程中的重要功能,并突出了Ddx5-microRNA-125b-Rybp上下游关系在体细胞重编程中的重要性。该研究首次揭示了RNA结合蛋白在体细胞重编程中的调控作用,同时揭示了RNA结合蛋白与表观遗传信息之间的crosstalk在细胞命运转变中发挥重要作用,为细胞命运转变的机制研究和技术开发提供了新思路。
该项目得到了国家自然科学基金委、科技部、广东省及广州市等经费的支持。
广州生物院揭示RNA结合蛋白DDX5在体细胞重编程中的关键作用和调控机制
附件下载:



