

发布时间:2019-10-15
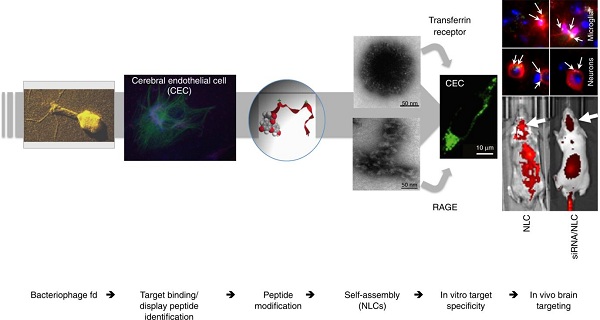
纳米颗粒载体在检测、监测和治疗各种疾病的特异性靶向性传递治疗药物和诊断试剂方面受到广泛关注。药物靶向载体的一个主要策略是对纳米颗粒进行多种靶向配体(如叶酸、抗体及其片段、功能多肽)的表面功能化,这一过程通常被称为“主动靶向”。 噬菌体展示技术是一种对于鉴定和筛选靶向多肽配体很有价值的工具。丝状噬菌体fd通过少量拷贝的噬菌体多肽就可以精准地特异性结合细胞靶点,但是用成百上千个人工合成的噬菌体多肽表面修饰的纳米颗粒则通常存在靶点结合弱的缺点,无法特异靶向相关细胞组织。巫林平课题组猜想一些噬菌体展示多肽是由其层级结构识别并结合它们的相关靶点,而不是其单体形式。为了证明该猜想,该研究选择脑靶向多肽GYR为突破口。数以万计的候选药物被开发用于治疗脑部疾病,但是98%的小分子药物和几乎100%的大分子药物,无法自由通过血脑屏障(BBB)进入大脑, 成为阻碍脑部疾病治疗的主要因素,因此急需开发特异高效的纳米载体使药物跨过血脑屏障转运进入大脑,从而能改变脑部疾病的治疗策略。GYR多肽是通过丝状噬菌体fd克隆展示筛选出来的15个氨基酸多肽,其在体外的人脑毛细血管内皮细胞hCMEC/D3和体内鼠脑内皮具有高结合特异性。但是GYR修饰的脂质体纳米颗粒却没有脑组织靶向性。为了克服这个缺点,该研究对GYR进行化学改性,赋予其两亲性,从而控制其自装行为。化学修饰的GYR多肽可以自组装形成核壳纳米颗粒和多重交叉的β折叠纳米纤维(简称为纳米配体载体)。
研究发现该层次结构的纳米配体载体通过转铁蛋白受体(transferrin receptor)和晚期糖基化终产物受体(the receptor for advanced glycation-end products)靶向脑内皮细胞,并可以高效穿过小鼠血脑屏障到达神经元和小胶质细胞。更为重要的是纳米配体载体可以装载靶向β-分泌酶1(BACE1)的siRNA分子(BACE1酶是产生β-淀粉样蛋白关键酶,而β-淀粉样蛋白在大脑中的过度累积是阿尔兹海默症典型的病理特征,所以BACE1酶是阿尔兹海默症治疗药物的热门靶点)通过静脉注射进入小鼠大脑中,并有效地抑制BACE1的表达。整个系统没有毒性和炎症反应。因此,该研究开发的纳米配体载体作为一种安全的多功能纳米载体,避免了噬菌体展示肽表面修饰纳米颗粒主动靶向有效性和特异性弱的缺点,通过化学修饰赋予多肽配体自组装形成可靶向的纳米载体来实现主动靶向性。为中枢神经疾病药物的脑靶向传递临床转化研究提供新的技术和理论基础。
广州生物院为论文第一单位,巫林平研究员和Moein Moghmi教授为通讯作者。该研究得到了国家重大新药创制、广州市科技计划项目等经费资助。
文章链接: https://www.nature.com/articles/s41467-019-12554-2
附件下载:

